

计算模拟平台
pk/pdj9九游会老哥俱乐部交流的解决方案 | 【上】phoenix nlme & trial simulator: m&s优化药物iii期试验设计来帮助获得fda批准
phoenix nlme 案例
j9九游会老哥俱乐部交流的解决方案 | 2022-02-17 10:58
声明:本文翻译自certara公司网站。
原文链接:
建模和模拟(m&s)正在改变药物开发以及药物如何接受监管审查的方式。certara公司旗下的phoenix nlme和trial simulator等定量药理学相关软件利用动物试验和临床试验现有数据建模,通过模拟减少不确定性,提高药物研发效率和生产力,并为赞助公司的药物研发做出更具成本效益的决策。
药物监管机构正在接受并大力推广m&s的使用,帮助加快药物和生物制品的批准。2018年,fda启动了一项基于模型的药物开发(midd)试点计划,并为赞助商提供了讨论药物开发项目的midd方法的机会。此外,fda还创建了m&s group,以支持m&s在药物研发领域的扩展,并通过行业指南向药物研发企业提供建议。因此,m&s已成为监管机构不可或缺的一部分,这些战略有助于为监管决策提供支持,预测临床和群体层面的结果,并为公众健康提供保障。
本文的例子来自clarus therapeutics(后续用clarus表示),一家专门从事男性健康的小型制药公司,他们正在开发一种口服睾酮(后续用t表示)替代产品,用于男性睾酮缺乏症。当clarus向certara寻求帮助时,ii期研究已经完成,iii期研究正在进行中。然而,clarus对iii期的结果有几点担忧。首先,平均t浓度(cavg)高于ii期研究中观察到的浓度。其次,与安全问题相关的t最大血浆浓度值(cmax)的男性比例高于ii期研究中观察到的比例。最后,根据性腺功能减退男性行业指南,t的 cmax值可能太高,fda无法接受,导致监管部门可能无法批准该产品。如果iii期的数据不足够支持有效性和安全性,clarus的产品就有可能无法获得批准,这也意味着公司业务面临非常大的挑战。
为了处理这种不确定性并解决这些问题,clarus提出了一项基于新研究设计的额外iii期试验,该研究将降低cavg(与疗效相关)和cmax(与安全性相关)。但这项新研究的试验设计是否合理?它会满足clarus自己的要求还是fda的要求?fda的要求之一是确定一个采血点,作为cavg处于正常范围的相对准确的预测指标。因此,certara建议使用m&s评估该iii期研究设计的各种可能的组合,以优化设计中对实现疗效和安全性目标最重要的因素。

为了更好地帮助clarus改进其新的iii期的研究设计,我们提出了两个对于满足fda要求以及确定疗效和安全性非常重要的目标:第一,确定采集“单个样本”替代物(给药后t浓度的测量)的最佳时间窗。第二,在整个iii期研究中确定剂量调整的方法和步骤,然后将其转化为药物使用说明和标签。此外,采血样本中的t浓度应保证cavg和cmax水平符合fda指南要求。指南中规定:cavg的药代动力学有效性终点在300至1000 ng/dl之间,cmax的药代动力学安全性终点是85%以上的男性<1500 ng/dl,cmax在1800至2500 ng/dl之间的男性<5%,cmax超过2500 ng/dl的男性概率为0(图2)。
图2 pk安全性和有效性终点
接下来,有必要考虑试验设计的哪些部分可以用m&s来评估和修改,从而满足上面提到的“两个目标”。有几个因素需要评估:例如 “单个样本”的收集时间窗口,将目前设定的给药后4-6 h采集单个样本更改为另一个范围是否会提高cmax有问题的受试者的百分比?另一个需要考察的因素是促使医生进行剂量调整的t的浓度阈值。降低或增大剂量调整阈值是否会提高cmax有问题的男性比例?还是说仍有超过75%的男性达到正常范围内的cmax?最后一个要考虑的因素是哪种滴定方法会改善结果?滴定方法包括从最低剂量开始,根据需要向上滴定;或者从剂量范围中间开始,根据需要向上和向下滴定。
为了回答这些问题,phoenix nlme开发了一个群体pk(pop pk)模型,以证明该模型在进行试验模拟和修改研究设计时具有合理的准确性和预测性(图3)。第一步是基于ii期和iii期数据开发基础模型,并评估体重、t的基线浓度和种族等协变量对模型的影响。下一步是通过拟合优度检查(gof)和视觉预测检查(vpc),证明该模型具有合理的准确性和预测性。最后,在试验模拟器中进行模拟,以便修改模型中的参数(即研究设计和各种可能的组合)。
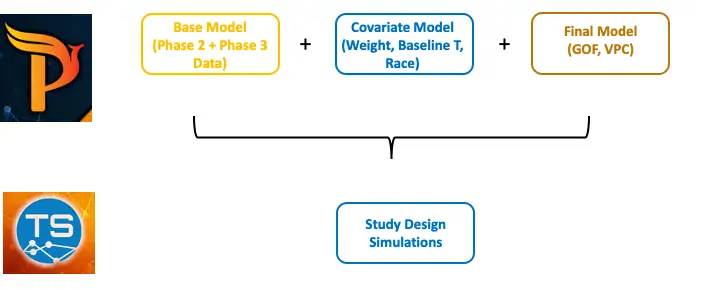
图3 建模与模拟的总体流程图
更多细节大家可以观看certara的在线研讨会:
我们将会在下一篇文章中回顾从试验设计的4个不同方面做修改后的模拟结果,最终iii期的研究设计做了什么改变,并最终获得fda批准。
原文作者:nastya kassir