

计算模拟平台
ds案例 | egfr和vegfr-2双重抑制剂的研究
j9九游会老哥俱乐部交流的解决方案 | 2020-04-13 16:31
表皮生长因子和血管内皮生长因子2属于酪氨酸激酶型受体,是治疗各种癌症疾病的重要靶标。组合抑制两个靶标以在信号途径中产生协同作用是鉴定新型酪氨酸激酶抑制剂的关键方法。在本研究中,合成了一系列衍生自4-氨基喹啉的双重抑制剂的新化合物。所获得的针对人癌细胞系的细胞毒性试验结果表明,针对a549的4c的细胞毒性活性为0.8 mm,与厄洛替尼相比,它具有很高的活性。使用基于结构方法中的药效团模型研究了在双重抑制剂和4c,并与在egfr和vegfr-2活性位点共结晶的4c进行了比较。它们显示了与凡德他尼,厄洛替尼和索拉非尼相同的结合模式。分子动力学模拟结果证实met769,lys721,asp1046和lys868是两个结合位点中与双重活性相关的重要残基。ala1050和pro968被确定为双重抑制的新氨基酸相互作用位点。50 ns的动态模拟结果表明,化合物4c在vegfr-2受体中显示出比vandetanib更有利的稳定性。设计的化合物的重要药效特征与先导化合物抑制剂相互作用之间的高度相关性使得对4-氨基喹啉抑制作用的结构基础进行更深入的了解。
ds hiphop 对一组化合物进行基于特性结构的比对并自动生成药效团模型的工具。
ds admet 提供了从化学结构预测吸收、分布、代谢、排泄(adme)和毒理性质的工具。
ds topkat topkat模块提供了化合物毒理性质预测工具。
ref:international journal of biological macromolecules 142 (2020) 94–113 if=4.784
链接:
表皮生长因子(egfr)和血管内皮生长因子2(vegfr2)属于酪氨酸激酶型受体,与细胞增殖过程中的信号传导密切相关,当dna突变后,异常的细胞增殖导致癌症的产生。egfr的突变在不同的癌细胞中发现。egfr和vegfr2都与肿瘤的产生密切相关,因此二者成为癌症治疗中的重要靶标。通常,多靶标治疗比单一靶标治疗更有效,因此,发现双重抑制剂可以提高抗肿瘤效果。如果能找到同时抑制egfr和vegfr2的双重抑制剂将大大提高抗肿瘤效果。本研究通过分子模拟方法,结合6个已知的egfr和vegfr2抑制剂,使用中hiphop产生了药效团模型,对6个设计合成并测过活性的双重抑制剂进行了构效关系研究,并使admet和topkat预测了该化合物的类药性和毒性。
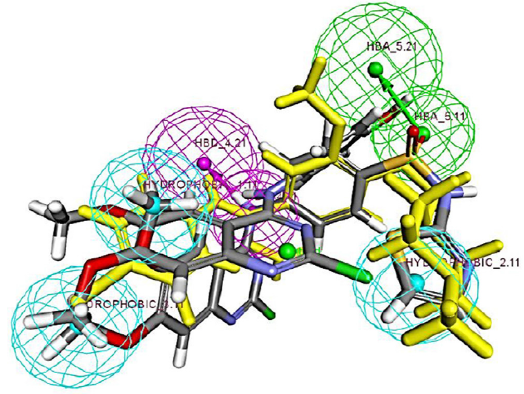
图一. 双重抑制剂与药效团模型的匹配模式
为什么选择?
1. ds hiphop 对一组化合物进行基于特性结构的比对并自动生成药效团模型的工具并且可以使用该药效团模型对未知活性化合物进行定性活性预测。
2. ds admet admet模块提供了计算adme/t预测值的工具,能够在药物发现的早期阶段就对可能有问题的新化学实体进行预测。运用这些模块将显著地降低药物发现的费用,同时节省了成功候选药物发展和评估的时间。
3. ds topkat通过化合物的二维结构信息构建高质量的qstr(定量结构-毒性关系)模型,并对各类有机化合物的诸如急性毒性、慢性毒性、诱变性、再生性等毒理性质进行预测,同时还可以考虑化合物对环境毒性的影响,大大节省实验的时间和投入。