
计算模拟平台
ds案例 | cdte / cds / zns量子点在黄曲霉毒素b1免疫分析及抗体识别分子模型中的应用
biovia discovery studio 案例
j9九游会老哥俱乐部交流的解决方案 | 2020-07-17 16:02
为了开发一种灵敏的黄曲霉毒素b1 (afb1)免疫测定方法,筛选了一种分泌具有高亲和力的抗afb1单克隆抗体的杂交瘤。合成了一种新型的cdte / cds / zns量子点,并将其与人工抗原偶联,用作简单的一步荧光免疫测定(flisa)中的荧光探针。已开发的flisa可以在0.08 ~ 1.97 ng/ml的宽线性范围内对谷物样品中的afb1进行灵敏测定,谷物样品的检出限为0.01 ng/ml。克隆并测序了fab片段的相应免疫球蛋白基因,并在hek293细胞中成功验证了fab的表达,对于afb1的kd值为1.09×10-7 mol/l。为了研究抗体与afb1之间的相互作用,对afb1和fab片段的同源模型进行了分子对接和分子动力学模拟。结果表明,ser32、trp93和trp98残基通过氢键形成、pi-pi堆积/ pi-烷基相互作用和范德华相互作用中的结合中起着最重要的作用。此外,afb1的静电势研究表明,静电相互作用在识别过程中也发挥了重要作用。理论研究结果为半抗原的设计和通过基因工程改进抗体提供了指导。
同源建模(homology modeling)是利用信息技术的手段,可以直接从蛋白的一级结构(氨基酸序列)预测蛋白质的高级结构(主要为三级结构)。人们可以通过使用一个或多个已知结构的蛋白(模板蛋白,template)来构建未知结构蛋白(目标蛋白,target)的空间结构。 为用户提供了一整套利用homology modeling方法自动预测蛋白质空间结构的工具。用户只需要提供蛋白质的氨基酸序列既可以轻松完成同源模型的构建及模型可信度评估的工作。
分子对接(molecular docking)是基于结构药物设计的核心模拟手段,依据受体与配体作用时的几何匹配和能量匹配过程,模拟受体-配体相互作用,预测两者间最佳的结合模式和结合亲和力。采用分子对接模拟技术,科研人员可以进行基于结构的药物虚拟筛选,药物分子的结构改造,配体和受体相互作用的机理研究等工作,从而大大提高实验效率。在 这一分子模拟的综合平台中,分子对接程序包含libdock、cdocker、flexible docking,这三种对接算法各有优势,能够满足广大科研工作者的多种应用需求,为其提供配体受体间相互识别的“利器”。
ref:analytica chimica acta. available online 26 september 2018, if=5.256
链接:
一、研究背景
黄曲霉毒素b1(afb1)是一种霉菌毒素,主要由寄生曲霉和黄曲霉在多种环境条件下在谷物成熟、收获和贮藏过程中产生。afb1污染食物链和环境会对人类、家禽和家畜产生各种潜在的有害后果。如致癌、胚胎毒性、免疫抑制和致畸作用。在众多afb1测定方法中,免疫测定由于其在短时间内分析大量样品的适用性、敏感性和快速反应性而成为最常用的方法,然而荧光免疫测定法(flisa)比传统的免疫测定法灵敏度更高,因此使用率不断提高。与此同时,镉量子点(qd)由于其独特的光谱特性,作为荧光信号探针的使用也有所增加。如cdte / cds / zns量子点包含cds和zns的壳,不仅可以使荧光强度急剧增加,而且zns壳可以阻止了有毒cd2 的释放,可作为荧光探针,在细胞标记和靶标分析方面具有广泛的前景。
二、fab的克隆及测序
采用pcr方法从抗afb1单克隆杂交瘤细胞中扩增出fd和lc基因,扩增产物分别为660 bp和642 bp的单扩增子。并使用kabat数据库和 2016 对基因进行测序,结果表明,扩增的vl基因属于iglv1基因家族,而vh序列属于ighv1基因家族。该基因序列显示无终止密码子的框内连接,说明序列重组正确,相关氨基酸序列。
三、mab的fab片段建模
使用 2016 软件构建mab 5a11c10a fab片段的三维结构。轻链和重链的模板结构首先使用pdb数据库中的blast search进行识别。为了建模的准确性,选择1mfmb,3bsz和3ks0的抗体晶体结构分别作为整体,重链和轻链模板。然后,通过将重链和轻链的模板叠加到整个模板上来确定两条链的相对空间方向,从而构建fab片段的结构。应用ramachandran图和profile-3d分析分别验证fab蛋白中的预测扭转角。
四、分子对接和分子动力学模拟
作者采用 程序中的半柔性分子对接方法cdocker进行了分子对接,以研究afb1抗体识别的特异性结合机制。结果显示,afb1很好地适合了由cdr区形成的疏水腔,表明afb1可以基于几何匹配原理有效地匹配fab的活性位点,并且cdr区的残基在afb1抗体识别中起着重要作用,氢键和pi-pi堆积/pi-烷基相互作用是将afb1和fab结合在一起的关键相互作用。为了获得更好的模拟结果,并对最佳对接模型进行了分子动力学模拟,并计算afb1和fab的结合自由能。
五、结论
在这项研究中,作者制备了一种新的抗afb1单克隆抗体,并合成了相对较新的cdte / cds / zns三元量子点可对afb1进行灵敏免疫测定,并且三元量子可用作荧光探针。与传统的elisa相比,开发的flisa的检测限低了四倍在这项研究中。然后根据同源建模的方法构建了fab片段的3d同源性模型,并进行分子对接和分子动力学模拟,以研究afb1抗体识别机制。这些方法可以让我们更好地了解半抗原抗体识别机制,可以指导未来的半抗原设计和通过基因工程改进抗体。
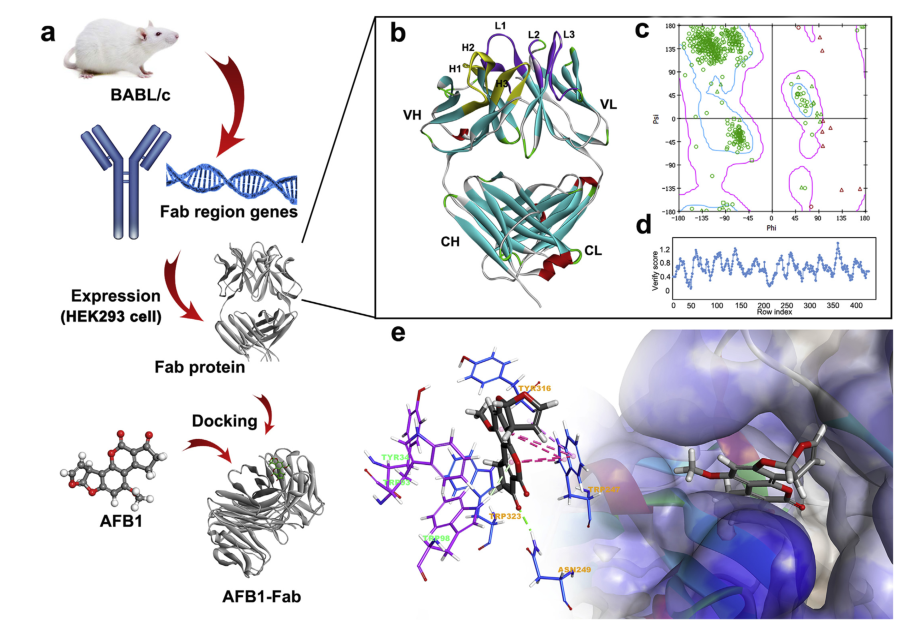
图1 (a) fab表达和分子建模工作流程;(b) fab三维模型和互补决定区域;(c) ramachandran plot和(d) fab域模型的profile-3d分析;(e) fab结合位点及fab与afb1对接后的相互作用。
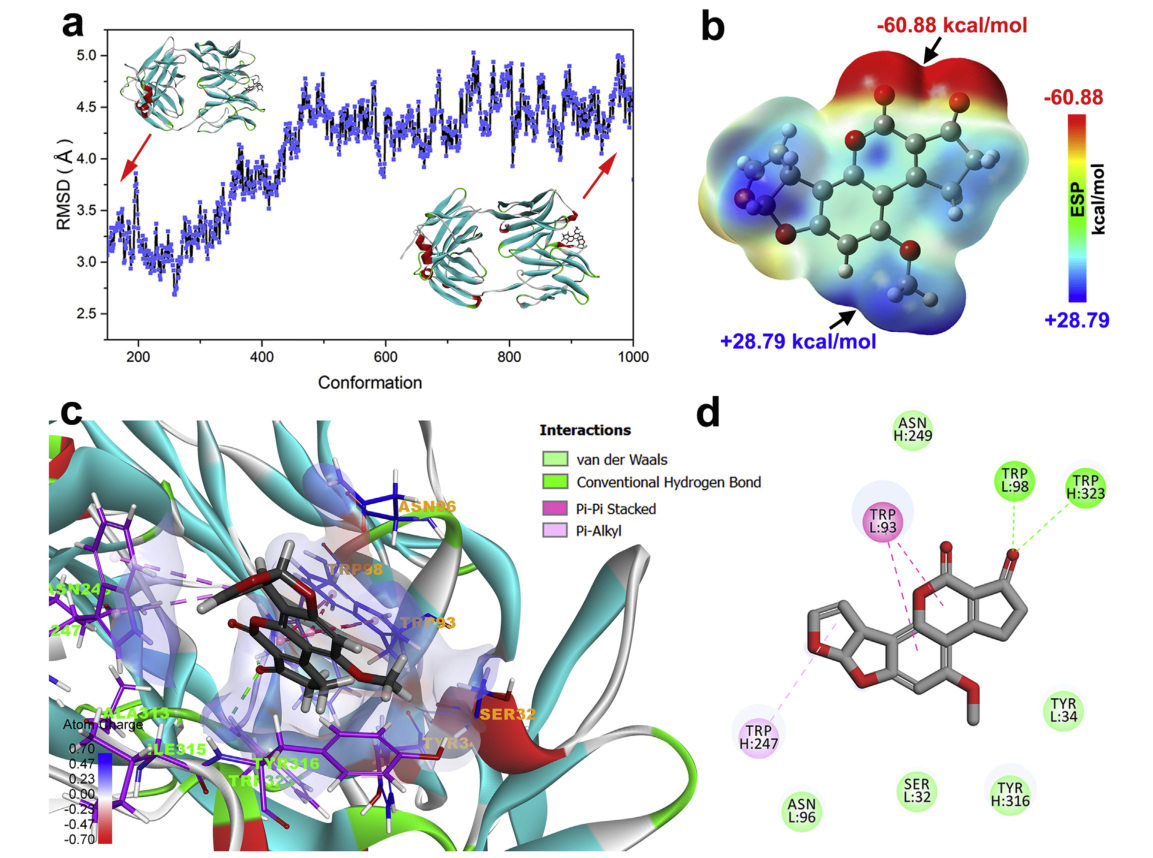
图2 分子对接与分子动力学模拟的结果图
表1 fab-afb1复合物中每个残基的相互作用能的分解值

为什么选择discovery studio?
1. 提供一整套同源建模的工具,使用ds,可以轻松完成所有的同源建模过程,你脑阔模板识别、序列比对、自动建模、模型的评估与优化;
2. 中同源建模工具可以预测多种类型生物大分子的结构,包括:球蛋白、抗体、跨膜蛋白等;
3. 中同源建模的核心程序是modeler,该算法非常经典,引用率比较高。
4. 中共有三种对接程序,这三种对接算法各有优势,能够满足广大科研工作者的多种应用需求;
5. 中有多种对接结果的评价分析手段,包括2d/3d相互作用图分析(可以分析氢键、疏水作用、卤键等多种非键作用类型)、结合口袋表面分析、氢键热图、多种打分函数、结合能的计算等;
6. 应用广泛,操作简便,图形化界面十分友好,结果易于分析。