

资讯动态
neotrident news
资讯动态
maxflow是以saas技术为基础,将人工智能、分子模拟与实验设计相融合的材料、药物研发平台。通过自主研发的工作流引擎和便捷的人机交互设计,用户可以图形化的方式在maxflow平台中将各种微观结构设计工具与人工智能模型以及物理模型相融合,将各种类型的数据与最新的人工智能框架相融合,自由构建适用于不同细分领域,不同类型材料、药物研发的自动化分析、筛选流程。
在倾听和采纳不同领域用户的使用反馈过程中,maxflow产品和技术开发团队积极创新,对平台功能的多样性、易用性以及稳定性不断进行针对性的改进和提升。
2024年2月1日在云端正式上线maxflow 3.10。新版本在大分子结构预测、分子动力学以及实验设计等多个方面均有明显的提升。

▇ alphafold2 蛋白结构预测
alphafold是基于ai的精确计算方法,该方法利用多序列比对,将蛋白质结构的物理和生物学知识融入到深度学习算法的设计中,即使在没有类似结构已知的情况下,也可以以原子精度预测获得蛋白质的结构。在第14届国际蛋白质结构预测竞赛(casp14)中,对alphafold进行了验证,证明其在大多数情况下与实验结构具有竞争力,并且大大优于其他方法。
alphafold2的主要变化是直接训练蛋白质结构的原子坐标,这不仅使得alphafold2在解析蛋白结构的速度上有了进一步的提高,而且对几乎所有的蛋白质都预测出了正确的拓扑学结构,其中有大约2/3的蛋白质预测精度达到了结构生物学实验的测量精度。
maxflow 3.10中增加“alphafold2蛋白结构预测”组件,仅需要输入蛋白质序列文件,即可直接预测目标蛋白质的三维结构,实现了端到端的预测。该组件支持对单体和多聚体两种类型蛋白质的预测,可输出多个候选预测结果,并且允许对预测结果进行进一步的动力学结构优化。
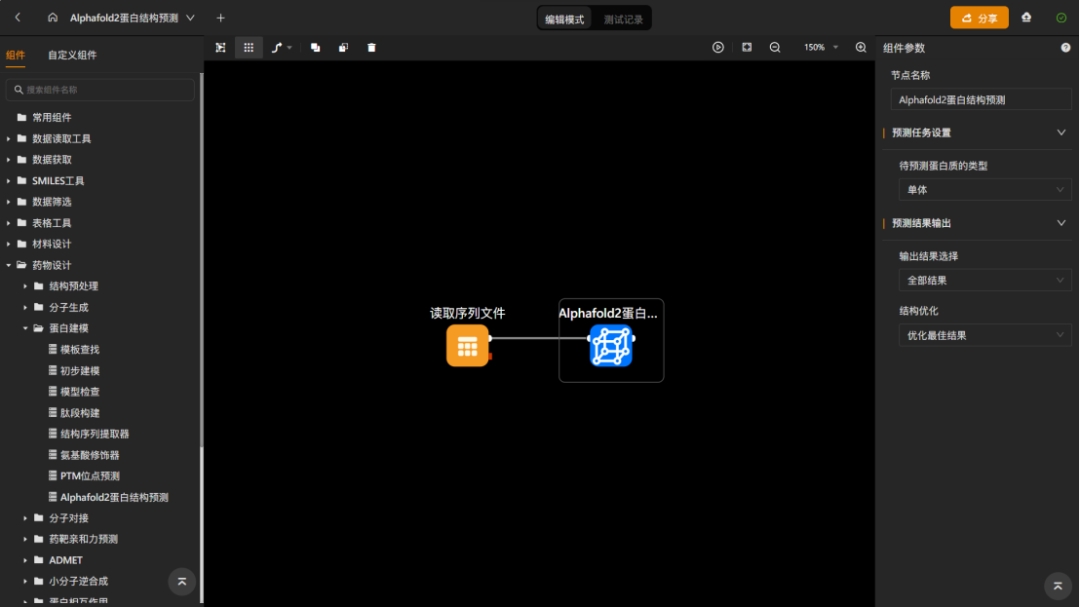
图 “alphafold2蛋白结构预测”工作流
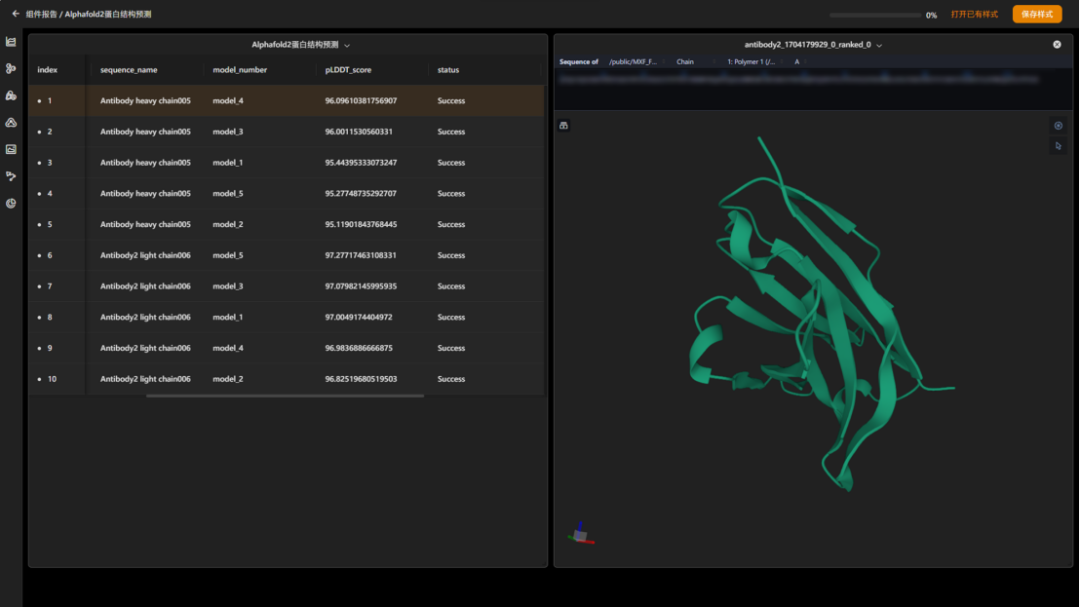
图 “单体蛋白质结构预测”结果报告
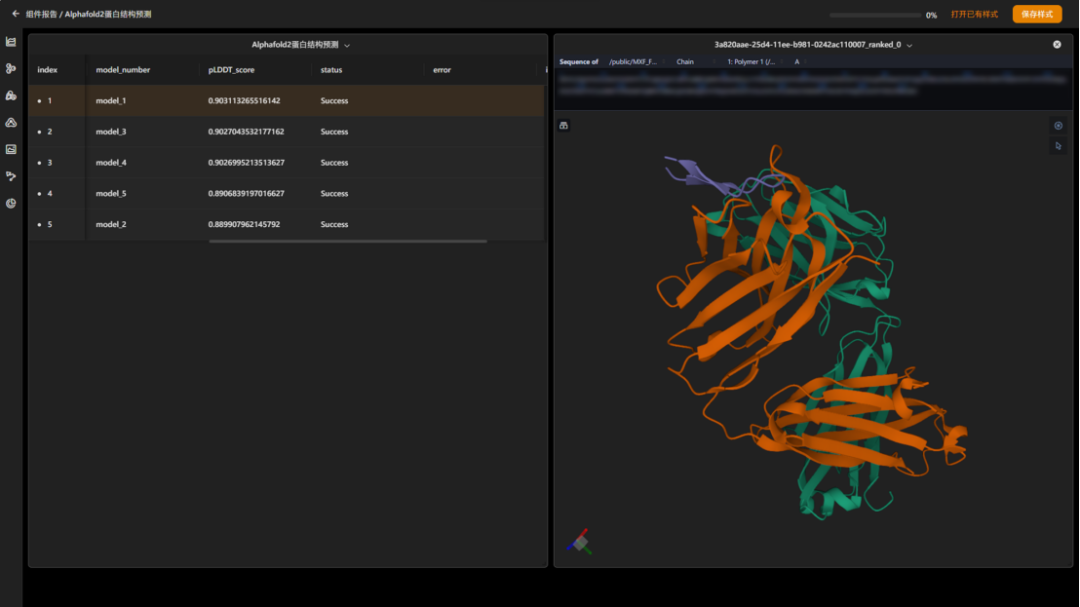
图 “多聚体蛋白质结构预测”结果报告
▇ 抗体结构预测
免疫受体蛋白在免疫系统中起着关键作用,并已显示出作为生物治疗的巨大前景,明确这些蛋白质的结构对于理解其抗原结合特性至关重要。在maxflow 3.10中,除了可以使用“alphafold2蛋白结构预测”组件进行免疫受体蛋白的结构预测,获得准确且具有生物学合理性的预测结构,还可以使用“抗体结构预测”组件进行免疫受体蛋白的结构预测。
“抗体结构预测”组件同样基于深度学习方法,基于大量免疫受体蛋白的结构进行训练,专门用于抗体、tcr和纳米抗体等免疫受体蛋白的结构预测。使用“抗体结构预测”组件预测免疫受体蛋白的结构,除了具有比拟alphafold2准确性,可保证预测结果的可靠性,预测效率还可以达到alphafold2的近百倍。
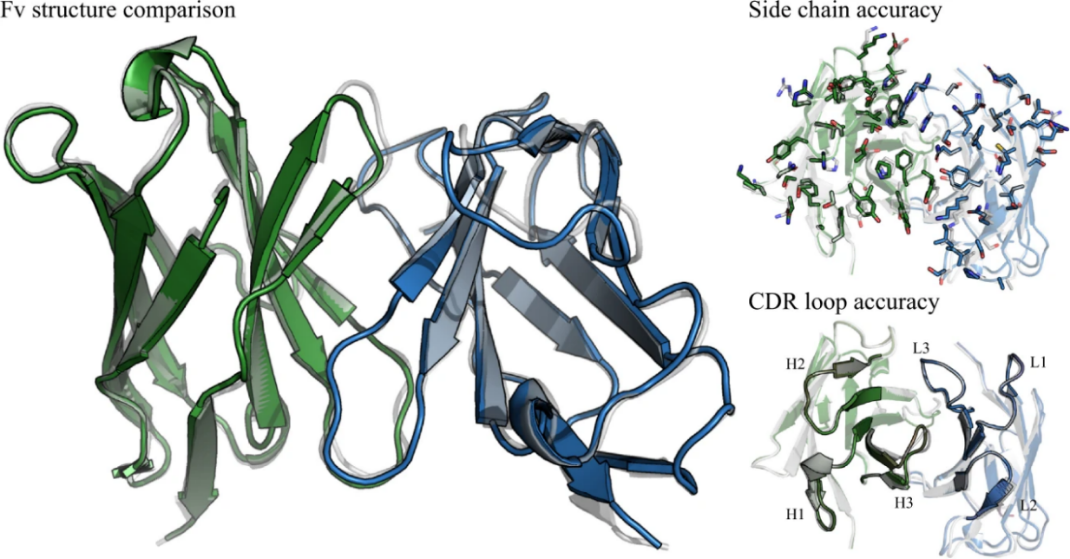
图 抗体fv预测结构与真实结构对比:真实结构为灰色,预测结构按链着色
abanades b, wong w k, boyles f, et al. immunebuilder: deep-learning models for predicting the structures of immune proteins[j]. communications biology, 2023, 6(1): 575.
“抗体结构预测”组件,仅需要输入免疫受体蛋白的序列文件,即可直接预测目标蛋白质的三维结构。
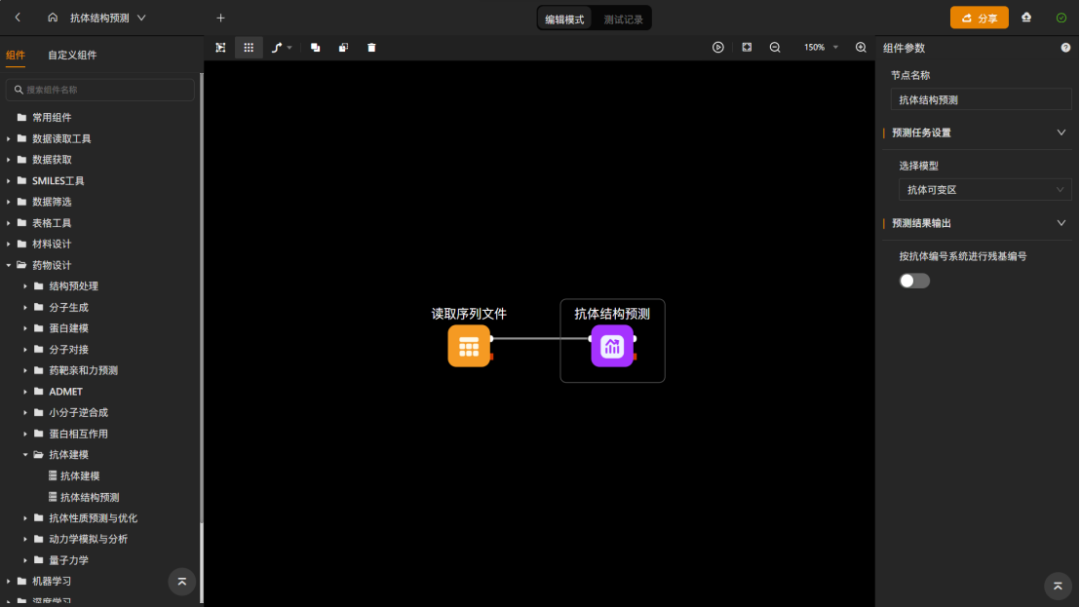
图 “抗体结构预测”工作流
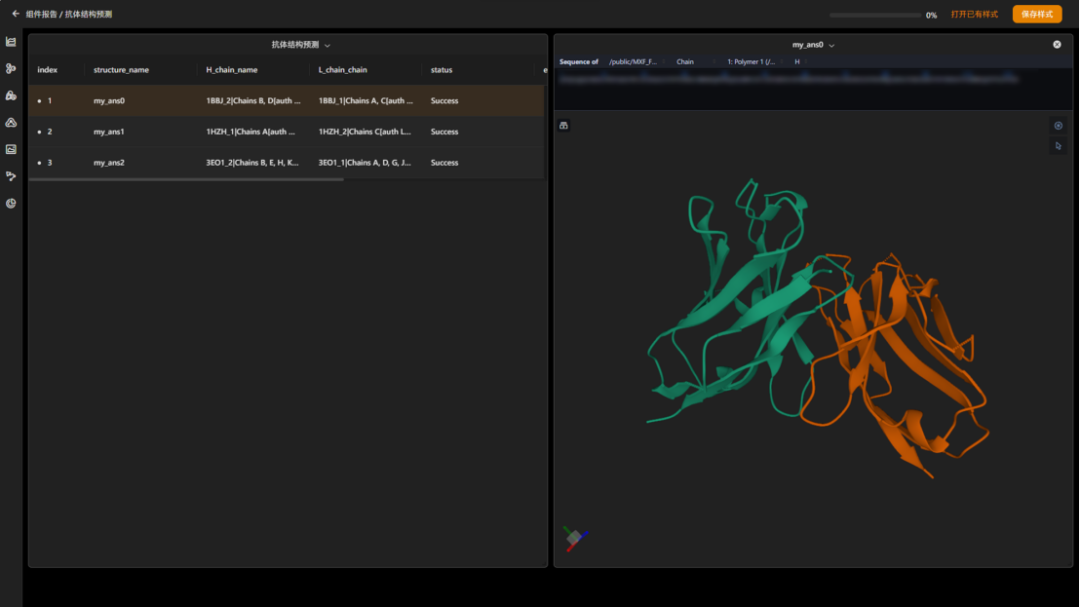
图 “抗体可变区结构预测”结果报告
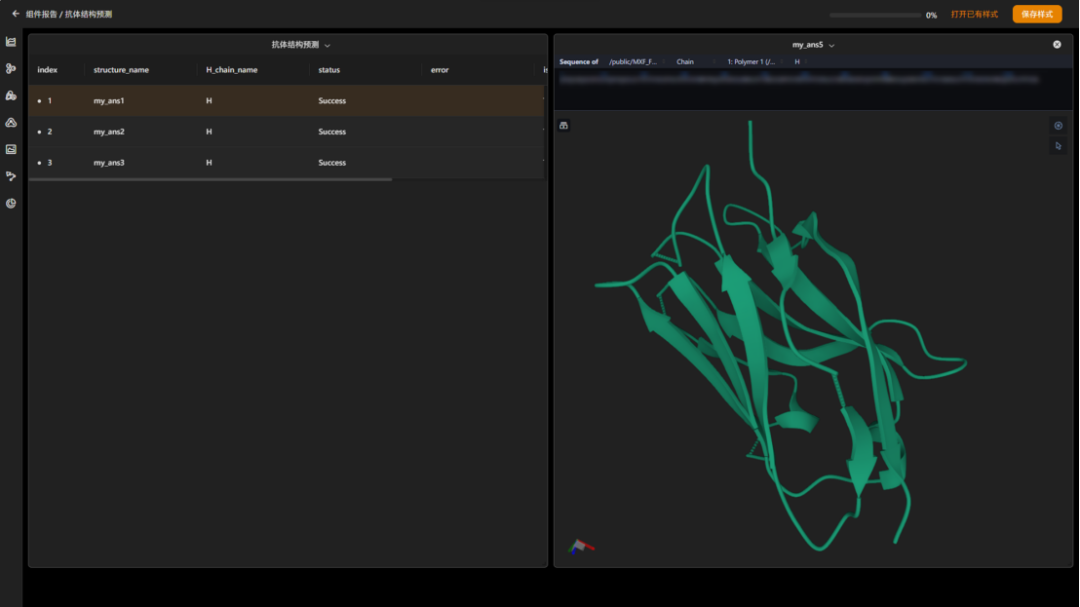
图 “纳米抗体结构预测”结果报告
结合 “抗体结构预测”组件与其他相关组件搭建工作流,可以进一步利用预测获得的免疫受体蛋白结构,从分子结构层面理解和研究免疫受体蛋白的作用机制。
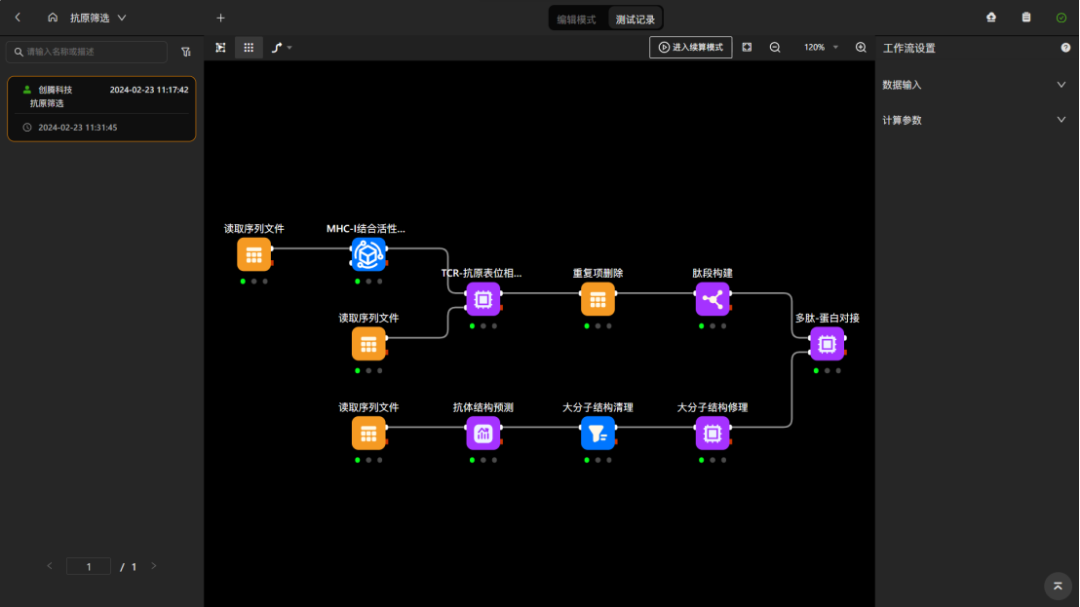
图 工作流:使用ai模型对抗原进行mhc结合活性及tcr相互作用筛选,并使用“抗体结构预测”组件预测获得tcr可变区结构,最后通过对接获得tcr-抗原复合物结构
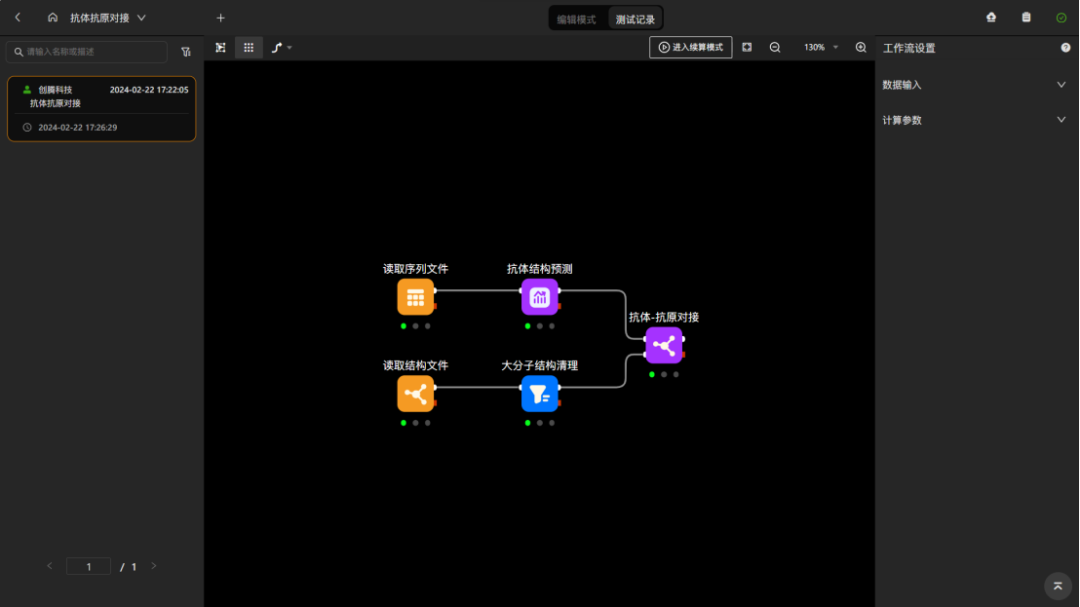
图 工作流:使用“抗体结构预测”组件预测获得抗体可变区结构,并通过对接获得抗体-抗原复合物结构
▇ 结合自由能计算
maxflow 3.10 正式上线“结合自由能计算组件包”,实现对主客体分子之间结合自由能的预测。组件包基于高效并行的分子动力学引擎,结合maxflow 产品以及技术开发团队在力场和动力学模拟方面的专家意见,实现了组件参数的最佳设置,用户可以在工作流界面通过简单拖拽就能设置复杂的计算过程,轻松与maxflow平台已有的mmgbsa、分子对接等其他虚拟筛选组件无缝衔接,实现从低精度到高精度的全面筛选覆盖。工作流可以反复使用、修改、分享,且支持仅计算失败窗口的重算和续算。
“结合自由能计算组件包”提供了受体和配体之间自动化的原子约束算法,并支持自定义和预定配体分子组,可实现复杂情况下主客体之间的结合自由能计算,如:膜蛋白体系,含多种溶剂的混合体系,多配体体系和含辅酶因子的核酸体系。
“结合自由能计算组件包”包含fep(free energy perturbation)和atm(alchemy transfer method)两种计算方法:
fep方法为传统炼金术的代表性方法,目前适用于所有电中性体系。它使用双解偶的方法来计算主客体之间的结合自由能,并且预定义了多种lambda 窗口和解耦相互作用方案,同时支持自定义窗口数量和解耦作用类型。
atm方法适用于所有体系,可以自动计算配体分子转移路径。与经典的fep方法不同,atm方法在单个溶剂化盒子中就能完成结合自由能的计算,不仅减少了计算量和简化了计算流程,还消除了由于配体净电荷扰动而进行结果校正的操作。在atm方法中,不再需要分别解耦静电和lennard-jones 相互作用、原子映射、定义软核参数,相比传统的炼金术方法更简单、更通用,特别是对于含骨架跳跃和电荷变化转化的体系。
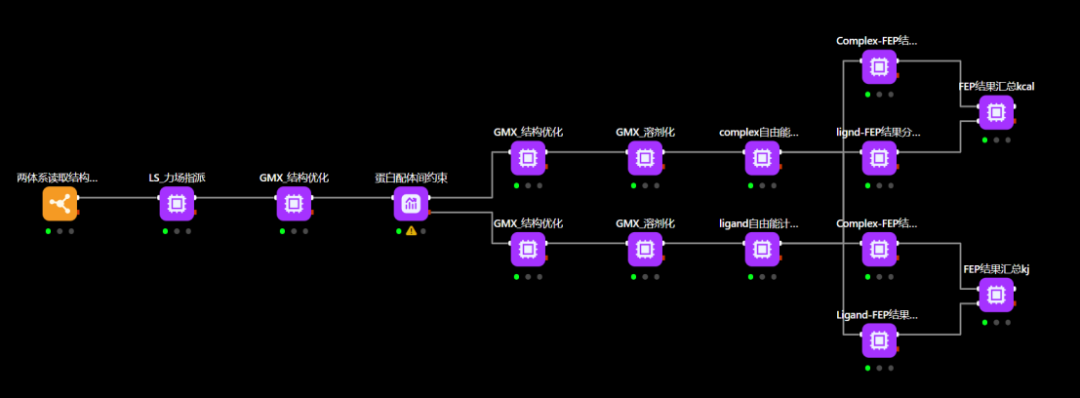
图 工作流:使用fep方法计算小分子配体和蛋白质受体之间的结合自由能
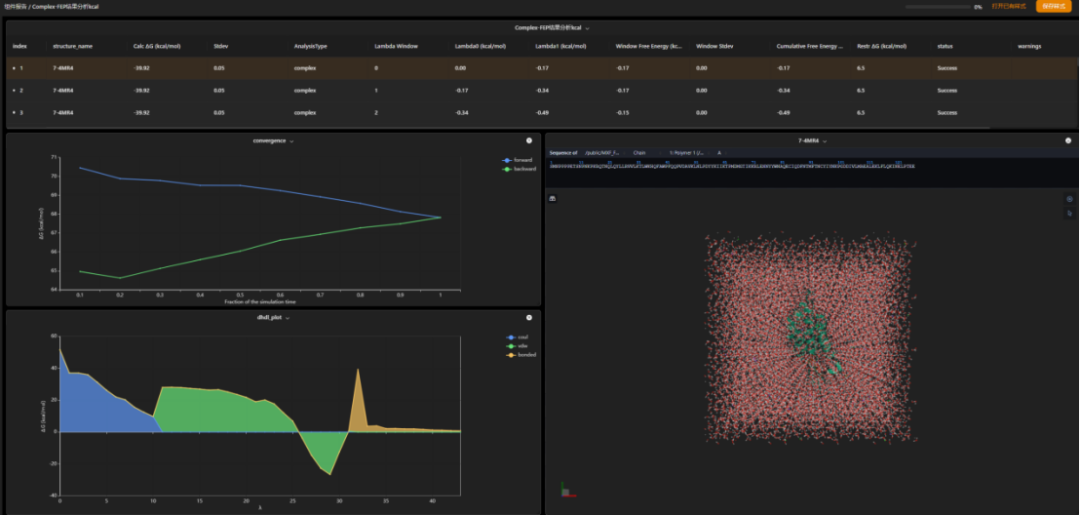
图 fep计算结果查看页面,表格中显示的是fep计算中各窗口的结合自由能,图表显示的是fep过程中的表征数据,通过它可以识别两分支中有问题的计算
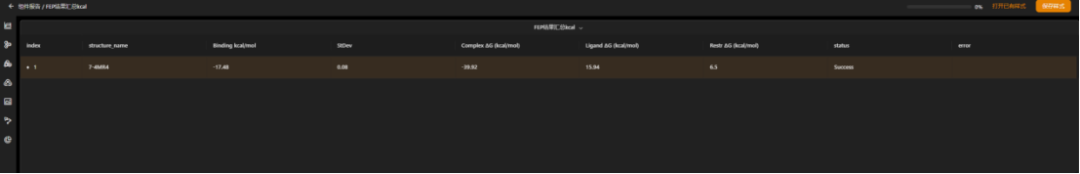
图 fep计算结果汇总页面,可以直接得到小分子配体和蛋白质受体之间的结合自由能结果
图 工作流:使用atm方法计算小分子配体和蛋白质受体之间的结合自由能
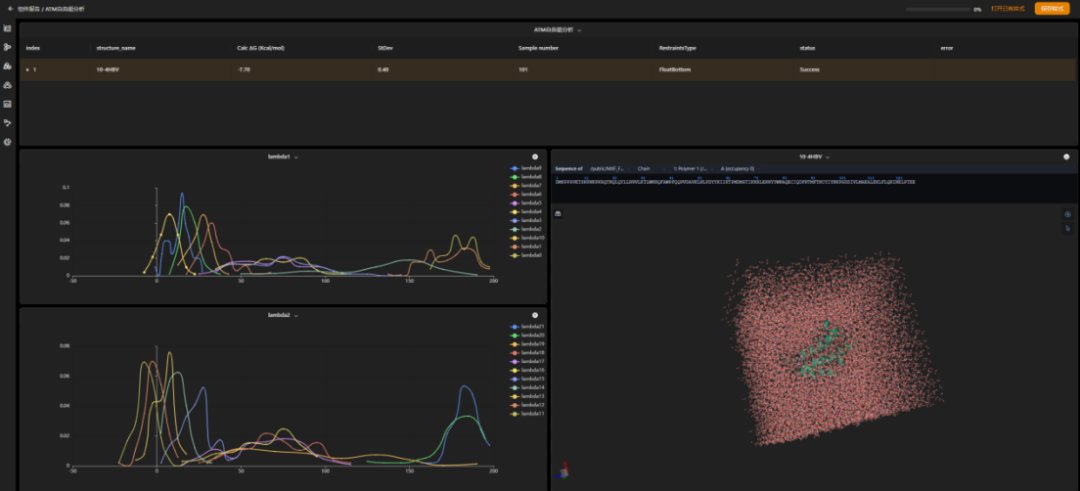
图 atm自由能分析结果查看页面,表格中显示的是小分子配体和蛋白质受体之间的结合自由能结果,图表显示的是atm过程中的表征数据,通过它可以识别有问题计算
▇ 基于贝叶斯优化的多目标变量实验设计
maxflow 3.10正式上线基于贝叶斯优化的多目标变量实验设计组件“edbo(experimental design based on bayesian optimization)”。
贝叶斯优化是一种用于高效优化黑箱函数的方法。它使用先验模型来估计未知目标函数的潜在形状,并通过选择下一个采样点来更新模型。这种迭代过程能够在有限的采样次数下逐渐收敛到全局最优解。
多目标优化问题是指在给定一组目标函数的情况下,找到一组解,使得在满足约束条件的前提下,这些解在所有目标函数上都是最优的。然而,多目标优化问题往往涉及到非线性、非凸或者高维的复杂搜索空间,因此寻找全局 pareto 前沿(pareto frontier)成为一个挑战。
新的edbo组件实现了贝叶斯多目标变量的帕累托(pareto)优化,将贝叶斯优化方法扩展到多目标优化领域。在每个迭代步骤中,它使用多个目标函数的采样来更新先验模型,并根据模型预测的 pareto 前沿来选择下一个采样点。不仅如此,新组件还可以更充分地利用已有的实验数据进行模型训练,进一步减少用户实验的次数和迭代循环次数。
图 工作流:edbo-exp-4组件代表第4轮循环得到的模型,通过这个工作流可以在它的基础上进一步获取第5轮的推荐实验点
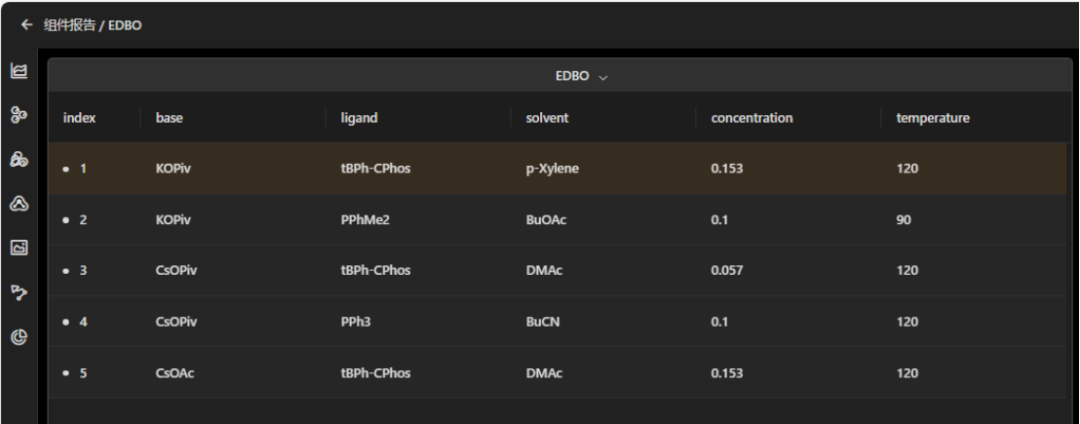
图 edbo的结果查看页面,表格中显示的是edbo组件给出的推荐实验点
扫码立即体验「分子模拟与人工智能平台」
