
计算模拟平台
ds案例 | brd4-hdac双靶标抑制剂可诱导结直肠癌细胞发生自噬
biovia discovery studio 案例
j9九游会老哥俱乐部交流的解决方案 | 2020-09-28 16:33
含溴结构域蛋白4 (brd4)和组蛋白脱乙酰化酶(hdac)均是癌症和其他慢性疾病中的表观遗传学靶标。本研究基于片段的药物设计、合成以及体外和体内评估,发现了一系列新型的基于噻吩并[2,3-d]嘧啶的异羟肟酸衍生物,作为选择性的brd4-hdac双靶标抑制剂。化合物17c对brd4-hdac双靶标的抑制效果最好,ic50值在纳摩尔水平。此外,17c通过诱导细胞自噬,对结直肠癌(crc)细胞增殖具有抑制作用。它在大鼠中具有良好的药代动力学特征,口服生物利用度为40.5%。在hct-116异种移植体内模型中,17c通过诱导细胞自噬并抑制il6-jak-stat信号通路,对肿瘤的生长表现出有效的抑制作用。结果表明,brd4-hdac双靶标抑制可能是crc的一种有效的治疗策略。
mcss (multi-copy simultaneous search) 作为一种片段对接的方法,可以被用来分析靶标结构中配体结合位点的特性。采用此方法,分子片段先被随机放置在结合位点中,然后程序采用charmm对这些随机片段进行能量优化以找到最适的片段位置。片段采用独立的mcss_score来打分和排序。
ludi是从头药物设计方法之一,使用ludi来发现新的具有潜在活性的化合物,并允许对已有的化合物进行改造。主要包括de novo receptor、de novo link、de novo evolution这三个protocols。
分子对接(molecular docking) 是基于结构药物设计的核心模拟手段,依据受体与配体作用时的几何匹配和能量匹配过程,模拟受体-配体相互作用,预测两者间最佳的结合模式和结合亲和力。采用分子对接模拟技术,科研人员可以进行基于结构的药物虚拟筛选,药物分子的结构改造,配体和受体相互作用的机理研究等工作,从而大大提高实验效率。在 这一分子模拟的综合平台中,分子对接程序包含libdock、cdocker、flexible docking,这三种对接算法各有优势,能够满足广大科研工作者的多种应用需求,为其提供配体受体间相互识别的“利器”。
ref:. published: march 10, 2020 if=6.205
链接:
一、研究背景
结直肠癌(crc)是全球最常见的恶性肿瘤之一。尽管已开发出针对crc的诊断和有效的治疗方法,但仍迫切需要用于治疗晚期crc的新疗法。另外,临床上使用的crc分子靶向药物,例如表皮生长因子受体(egfr)抑制剂,西妥昔单抗和贝伐单抗,在转移性crc(mcrc)患者中活性有限。crc的表观遗传学改变被认为是mcrc的重要生物标志物,在表观遗传学靶标中,肿瘤组织中的组蛋白乙酰化是mcrc中最常见的变化之一。在组蛋白乙酰化的过程中,含溴结构域的蛋白4 (brd4)和组蛋白脱乙酰化酶(hdac)被认为是潜在的治疗靶标。brd4是识别组蛋白或非组蛋白底物的核心元素,可调节表观遗传修饰和基因转录中的许多分子和细胞过程。hdac可促使赖氨酸残基脱乙酰化反应的进行,最近被认为是人类恶性肿瘤的潜在治疗靶标。brd4和hdacs可以协同下调c-myc表达并抑制crc的发生和转移。
在本研究中,通过中mcss的方法设计和合成了一系列新型brd4-hdac双靶标抑制剂,并进行了一系列后续的体内和体外生物学评估。此外,化合物17c通过下调c-myc,组蛋白h3脱乙酰化,抑制凋亡相关蛋白bcl-2并干扰hct-116结直肠癌细胞中自噬酶体的形成,诱导凋亡和自噬。western blot和ihc分析均显示17c有效抑制组蛋白h3的脱乙酰化作用。此外,17c对hct-116结直肠癌异种移植小鼠表现出良好的治疗效果,并通过激活il6-jak-stat信号通路增加了细胞毒性t细胞浸润。总之,设计并合成的一系列新型小分子brd4-hdac双靶标抑制剂,与rvx-208和vorinostat相比,17c对结直肠癌表现出优异的抗增殖能力,这表明17c是通过抑制brd4-hdac并诱导细胞自噬。
二、新型brd4-hdac双靶标抑制剂的设计
为发现brd4-hdac双靶标抑制剂采取了四步策略:一是基于mcss对brd4抑制剂的设计。首先,将从已知brd4抑制剂产生的片段嵌入zinc数据库中,然后分别对接到brd4蛋白的两个溴结构域中,得分最高的片段被选为新型brd4抑制剂的骨架,并且筛选出的片段具有三个结构特征:与za-loop氨基酸残基稳定的氢键相互作用、kac结合袋中的范德华和氢键相互作用以及在结合位点外部满足空间要求的疏水片段,然后再通过ludi对这些片段进行合并或优化。二是基于这些筛选的片段,合成了24种化合物,并测试了化合物对brd4抑制的活性,并将化合物4l作为双靶标抑制剂的骨架。三是典型的hdac抑制剂包含三个片段:帽子、疏水性接头和zbg基团。所以在brd4-hdac双靶标抑制剂的设计中,化合物4l被用作帽子,作者基于之前的研究将3,5-二甲基-4-羟基-苯基上的羟基作为连接点,并选择n-羟基己酰胺和邻苯二甲酸酯片段作为zbg基团,以分别探索帽片段的正确连接方式。四是合成了一系列模型化合物,并测试了这些化合物对brd4-hdac抑制的活性和对细胞增殖抑制的活性。在这些化合物中发现17c对brd4-hdac的抑制活性较好。
三、17c与brd4、hdac2和hdac6蛋白作用机制的研究
使用分子对接的方法将化合物17c对接到的brd4,hdac2和hdac6蛋白的结合口袋中,对接结果发现异羟肟酸酯基团在hdac的结合位点与锌原子稳定地螯合。噻吩并[2,3-d]嘧啶片段对接到表面凹槽中并很好地占据帽区域。异羟肟基的羰基片段可以分别与hdac2的tyr308和hdac6的tyr745形成氢键相互作用。17c结构中的羟胺片段分别通过稳定的氢键与hdac2的his145/his146和hdac6的his614相互作用。另外,在噻吩并[2,3d]嘧啶的2-位取代的苯基与hdac2的arg275形成阳离子-π相互作用。此外,噻吩并[2,3-d]嘧啶的3-氮原子和4-羰基可与brd4的asn140形成氢键。总之,分子对接结果与酶促测定结果显示出比较高的一致性。
四、结论
为了开发新型的brd4-hdac双重抑制剂。作者综合采用中的mcss、ludi和libdock的方法设计、合成了一系列噻吩并[2,3d]嘧啶的异羟肟酸衍生物,并对其体外和体内活性进行了评估,发现17c对hdac-brd表现出良好的抑制活性和选择性。并且通过一系列体外和体内实验验证了17c是brd4-hdac双靶标抑制剂,是crc新型化学疗法的潜在先导化合物。因此,通过分子模拟的方法可以指导新型药物分子的设计和改造,大大加快新药设计的速度,节省创制新药工作的人力和物力。
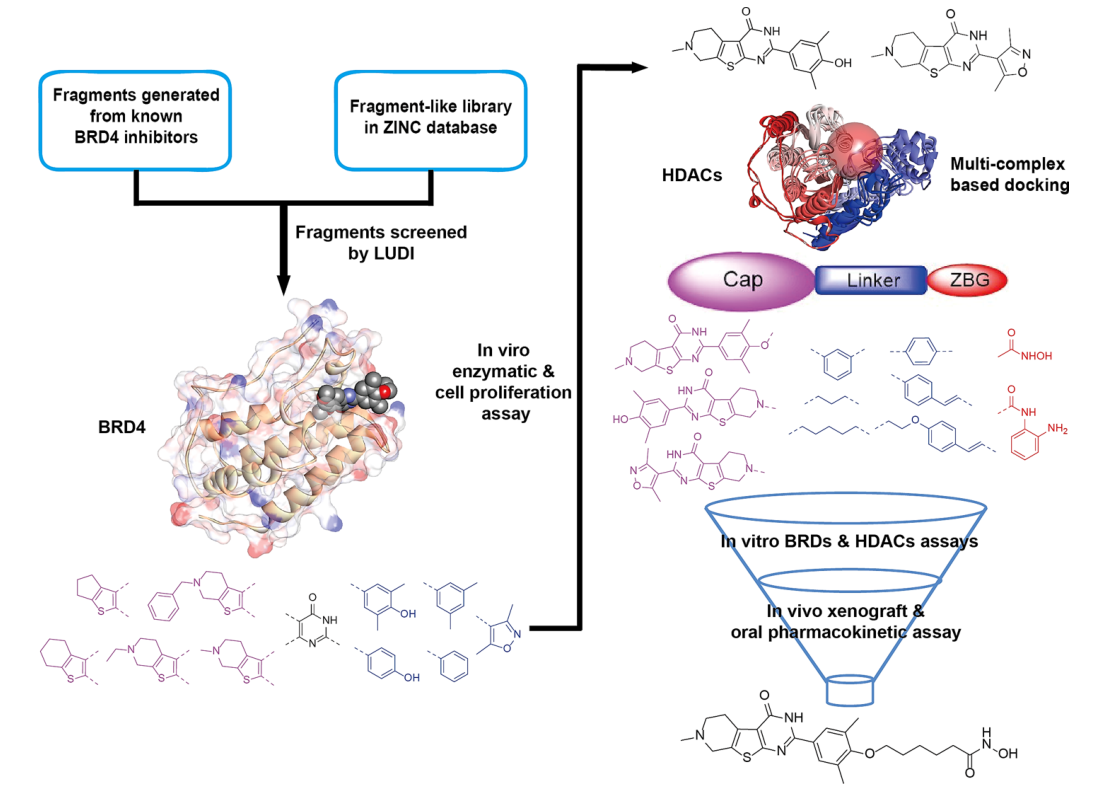
图1 新型brd4-hdac双靶标抑制剂设计思路
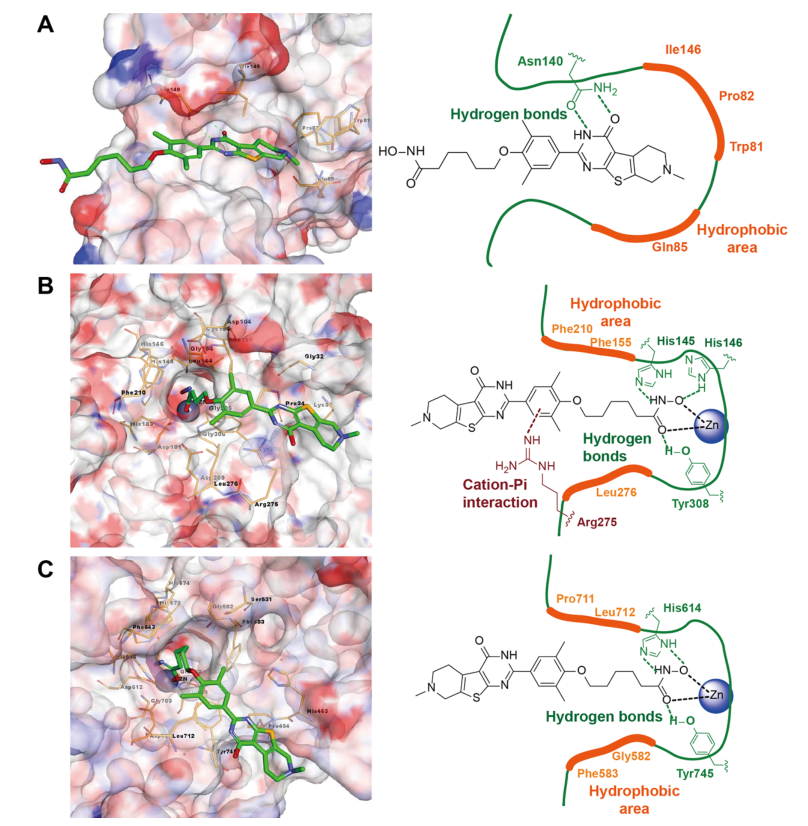
图2 17c与brd4 (a)、hdac2 (b)和hdac6 (c)相互作用模式图
为什么选择biovia discovery studio?
1. biovia 采用经典的mcss算法实现fbdd;
2. biovia 中ludi包括三种protocol可以满足科研工作者从头设计药物的需求;
3. biovia 中共有三种对接程序,这三种对接算法各有优势,能够满足广大科研工作者的多种应用需求;
4. biovia 中有多种对接结果的评价分析手段,包括2d/3d相互作用图分析(可以分析氢键、疏水作用、卤键等多种非键作用类型)、结合口袋表面分析、氢键热图、多种打分函数、结合能的计算等;
5. biovia 应用广泛,操作简便,图形化界面十分友好,结果易于分析。