
计算模拟平台
ds案例 | λ动力学可自动、准确和扩展的计算蛋白与配体的相对结合自由能
biovia discovery studio 案例
j9九游会老哥俱乐部交流的解决方案 | 2020-12-28 09:32
在先导化合物优化的过程中,准确预测配体和受体的结合能对先导化合物的优化是非常重要的。相对自由能微扰(fep)的方法是为此目的使用最广泛的方法之一,但是涉及大量的计算,因此将它们的应用限于少量化合物。lambda dynamics 也严格地基于统计力学的原理,提供了一个更有效的替代方法。
在本研究中,我们借用和描述和分析了基于charmm力场可gpu加速的multi-site lambda dynamics(msld)工作流的开发。该工作流可用于探索性筛选先导化合物的修饰,使组合库的相对结合能计算成为可能。并使用了7种蛋白质的不同的同源配体数据集和实验结合能数据对该工作流的准确性和可靠性做出了验证。另外,在150 ns或更短的采样时间下,该方法在大多数情况下,无论对于小型还是大型组合库,平均误差均低于1 kcal/mol。对于多位点系统,该方法的效率估计比fep应用程序高一个数量级。因此,结果表明,所提出的msld工作流可有效筛选组合库,可用于快速探索化学空间以优化结合能,从而在先导化合物优化方面具有实用价值。
ref:j. chem. theory comput. published online17 november 2020, if=5.011
链接:
一、研究背景
在药物发现过程中化合物与靶蛋白的结合能是先导化合物优化阶段的关键性质,而先导化合物优化是一个耗时且成本高昂的阶段。通过结合能的准确预测可以优先考虑改造或优化后活性可能提高的化合物来减少实验。另外,可以探索更大的化学空间,从而实现同时满足多种性能约束的更高质量的化合物设计。基于显示溶剂的自由能方法提供了一个完整的原子描述的受体-配体系统,因此具有准确预测结合亲和力的潜力。在这类方法中,相对自由能法特别适合于先导化合物的优化,因为它们需要根据先导化合物的化学变化来估计相对结合能。尽管相对自由能方法比绝对自由能方法有效得多,但计算成本很高。相对自由能微扰(fep)的计算通常需要为每个筛选的配体进行60-390 ns的分子动力学采样。因此迫切需要探索和开发能够以较低的计算成本准确预测结合能的方法。lambda dynamics(ld)是一种相对自由能方法,其中将耦合变量λ被视为具有虚拟质量且与系统动力学耦合的动态变量。与fep或热力学积分(ti)不同,ld在单个模拟中实现了热力学终态之间的转换,并且随着方法的不断改进已将ld扩展到multi-site lambda dynamics(msld)。
二、研究过程
在 和 中完成了msld工作流运行的所有计算。该软件的2020版包含msld所有功能,主要包括建立msld系统、运行偏差优化、采样计算和整理结果。另外,还包括用于列举核心配体上的r基团特征和产生配体的初始结合模式的方法。本研究中讨论的计算均是使用该软件的开发版本运行的,主要包括蛋白质制备、配体结合模式生成、力场分配、msld多拓扑设置、msld偏置优化、采样计算和结果分析。
为了验证工作流,使用了7种蛋白质的不同的同源配体数据集和实验结合能数据进行了检验。提出了一种自动迭代调整偏置电势以使任何msld自由能平坦化的方法,从而增强了采样并允许有效地估计自由能差异。该方法首先在大量模拟不同取代基的配体亚群上进行验证,显示了准确和可靠的性能。并且还测试了工作流的可扩展性,以筛选在单个系统中建模的100多个配体。在累积采样时间为150 ns或更短的情况下,该方法在大多数情况下对大小组合库的平均误差都低于1 kcal/mol。对于多位点系统,该方法的效率估计比fep应用程序高一个数量级。因此,结果表明,所提出的msld工作流可有效筛选组合库,可用于快速探索化学空间以优化结合能,从而在先导化合物优化方面具有实用价值。
三、msld的应用
msld除了可以计算组合文库的相对结合能之外,msld的模拟轨迹还可以为不同配体的结合模式提供结构上的洞见。此类信息可能有助于产生额外的设计想法,从而提高化合物的亲和力。例如,p38mk-7体系中的位点2-sub 4基团存在于6种最有利的化合物中,了解包含该取代基的配体之间的相互作用可能对理解其有利的亲和力具有重要意义。分析表明,该蛋白中位点2-sub 4基团环己醇基与asp109羧酸基之间存在水介导的相互作用。而从模拟中收集到的结构和动力学信息的另一个例子是hsp90-2系统,其中位点1-sub 8基团的相互作用导致蛋白质袋的扩大。这些信息可指导相关蛋白质构象在后续设计中的使用,这些设计涉及该取代基的功能化,以进一步增强结合亲和力。
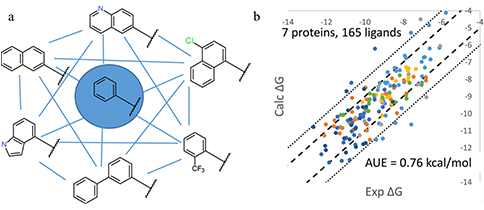
图1 (a) msld工作流的应用示图;(b) 对msld工作流的准确性和可靠性的验证

图2 msld的模拟轨迹代表性结合模式。(a) p38mk-7体系;(b) hsp90-2体系
为什么选择discovery studio?
1. biovia 中包含了msld运行所需的所有protocol,包括建立msld系统、运行偏差优化、采样计算和整理结果;
2. biovia 应用广泛,操作简便,图形化界面十分友好,结果易于分析。