
计算模拟平台
ds案例 | protac可选择性的降解cdk亚型
biovia discovery studio 案例
j9九游会老哥俱乐部交流的解决方案 | 2021-02-02 11:18
细胞周期蛋白依赖性激酶周期(cdk)是一组丝氨酸/苏氨酸蛋白激酶,cdk通过对丝氨酸/苏氨酸蛋白的化学作用驱动细胞周期和周期蛋白cyclin协同作用,是细胞周期调控中的重要因子。在研究cdk抑制剂时,与其他cdk同源物脱靶效应相关的毒性往往成为临床问题,并阻碍其进一步的治疗发展。为了提高疗效并降低毒性,作者使用靶向蛋白水解的嵌合体(protac)方法,设计并进一步优化靶向多个cdk小分子降解体,发现化合物a9选择性降解cdk2,并且还鉴定了一种双降解剂化合物f3,它可以有效诱导cdk2 (dc50:62 nm)和cdk9 (dc50:33 nm)的降解。在人前列腺癌pc-3细胞中,化合物f3通过有效阻断细胞周期s和g2/m期来有效抑制细胞增殖。初步数据表明,以protac的方法使cdk2/9降解可能是一种有效的治疗方法。
分子对接(molecular docking)是基于结构药物设计的核心模拟手段,依据受体与配体作用时的几何匹配和能量匹配过程,模拟受体-配体相互作用,预测两者间最佳的结合模式和结合亲和力。采用分子对接模拟技术,科研人员可以进行基于结构的药物虚拟筛选,药物分子的结构改造,配体和受体相互作用的机理研究等工作,从而大大提高实验效率。在这一分子模拟的综合平台中,分子对接程序包含libdock、cdocker、flexible docking,这三种对接算法各有优势,能够满足广大科研工作者的多种应用需求,为其提供配体受体间相互识别的“利器”。
ref:eur. j. med. chem. accepted 3 december 2019, if=5.573
链接:
一,研究背景
细胞周期蛋白依赖性激酶(cdks)是人类21种基因编码的丝氨酸/苏氨酸蛋白激酶。cdk1、2、4和6在真核细胞周期检查点调节中发挥着广泛的作用。该家族的第二类分支cdk7、8、9、12和13被确定为转录调节子。cdk4/6,它在细胞周期中与细胞周期蛋白d形成活性复合物,该复合物使视网膜母细胞瘤蛋白(prb)磷酸化,从而减少e2f家族对转录因子活性的抑制。随后在g1期后期,cdk2在与细胞周期蛋白e结合后进一步磷酸化rb蛋白,有效缓解e2f的抑制作用,使细胞周期进入s期。在整个s期中,cdk2与细胞周期蛋白a结合可控制dna合成的进程。在细胞增殖失调的癌症中,cdks的过度表达通常是癌症发病机理的驱动力,因此,靶向cdks成为治疗癌症的重要手段。小分子cdk抑制剂已用于临床研究中,但治疗效果差和严重的毒性反应阻碍了它们的临床发展。新兴的蛋白水解靶向嵌合体(protac)技术将小分子与e3泛素连接酶的配体连接起来,通过把靶标蛋白质招募到e3泛素连接酶附近实现靶向蛋白质的多泛素化,最后被蛋白酶体降解。protac技术可选择性降解特定的同源蛋白,包括含溴结构域蛋白的成员以及cdk。而cdk2尚未被确定为可降解目标。cdk2的泛素化能有效、安全地抑制肿瘤细胞的生长,但cdk2的降解可以消除肿瘤细胞分化的阻滞。靶向cdk2的降解探针的研究可有助于了解cdk2的功能,并探索对癌症的潜在治疗干预。在本研究中,首次报道了新型cdk小分子protac降解剂的设计和合成,该降解剂可单独降解cdk2或双重降解cdk2/9。其中一些通过下调包括原癌基因产物在内的cdk2/9信号通路,抑制前列腺癌pc-3细胞的增殖,具有潜在的治疗价值。
二,研究过程
protac是一个两头含有不同配体的化学分子,一头是结合e3连接酶的配体,另一头是结合细胞内蛋白质的配体,这两个配体再由一段linker连接起来。在本研究中为了确定合适的连接点,作者通过使用中的cdocker将已知抑制剂at-7519和fn-1501对接到cdk2蛋白中(pdb id:2vth),并根据cdocker energy选出最好的结合模式(如图1)。如预期的那样,抑制剂的疏水端与linker连接。但是由于linker长度和抑制剂的连接点不确定。因此,基于at-7519 (a1-a10)和fn-1501 (f1-f10)分别设计了一系列化合物,并通过生物实验测试了这些化合物是否降解cdk亚型,发现化合物a9可选择性降解cdk2,化合物f3可以有效诱导cdk2和cdk9的降解。
三,结论
在这项研究中,作者设计和合成了两个系列的化合物,并通过western blot评估了它们对cdk的降解活性。在at-7519系列中,发现a9可选择性降解cdk2,它在设计更有效的cdk2降解剂时具有很高的参考价值。基于fn-1501的系列中的大多数化合物都实现了cdk2/9双重降解或选择性cdk9降解。但是化合物f3的降解活性较高,该化合物对多种细胞系中cdk2和cdk9显示出有效且快速降解,因此它具有治疗多种癌症的潜力。总之,通过分子模拟的方法可指导实验的进行,并加快实验的进程。
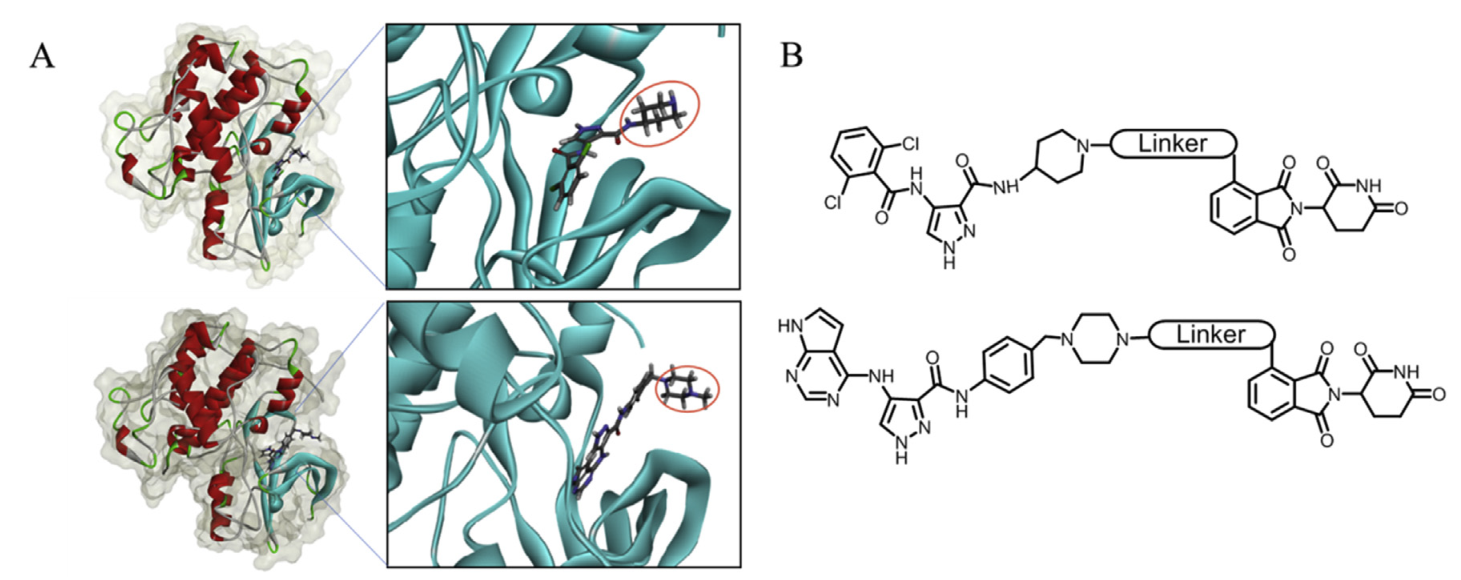
(a) cdk2(pdb id: 2vth)与at-7519(上)和fn-1501(下)结合模式;(b)基于at-7519和fn-1501设计protac分子的化学结构。
为什么选择 biovia discovery studio?
1. biovia 中共有三种对接程序,这三种对接算法各有优势,能够满足广大科研工作者的多种应用需求;
2. biovia 中有多种对接结果的评价分析手段,包括2d/3d相互作用图分析(可以分析氢键、疏水作用、卤键等多种非键相互作用类型)、结合口袋表面分析、氢键热图、多种打分函数、结合能的计算等;
3. biovia 应用广泛,操作简便,图形化界面十分友好,结果易于分析。