

资讯动态
neotrident news
资讯动态
近日,中国药监局药物评审中心发布了《窄治疗指数药物生物等效性研究技术指导原则 (征求意见稿)》(http://www.cde.org.cn/news.do?method=largeinfo&id=ac22bd0e8f49a0f9),原则中对窄治疗指数药物概念、统计方法以及分析报告格式均做了比较详细的描述,大家也可以根据提供的反馈表格向cde反馈自己对于该指导原则的想法,帮助完善指导原则。
引言
治疗指数较窄的药物在治疗剂量和毒性剂量水平之间的范围很窄。传统的平均生物等效性(abe)方法对于ntids可能不是很合适,因为药物暴露的微小变异(如20%)可能导致严重的治疗失败或药物不良反应。对于ntids,通常来说,80.00%-125.00%的abe限值被认为不够严谨,一些监管机构已经将生物等效性的限值缩小到90.00 111.11%。对于ema、加拿大卫生部和日本pmda,只需要使用的abe分析,但是90%置信区间限制更加严格。ena根据每个药物不同可能会设置不同的区间限制,90.00-111.11%居多;加拿大卫生部auc为90.00%-112.0%,但cmax还是80.00%-125.00%; pmda则统一为90.00%- 111.11%。
美国fda《draft guidance on warfarin sodium》us fda, recommended dec 2012.提出了一种新的ntids生物等效性统计方法,使用rsabe的算法,以参比制剂的个体内变异来对生物等效性区间限制进行缩放,比如当cvwr等于10%,90%ci为90.00%-111.11%。
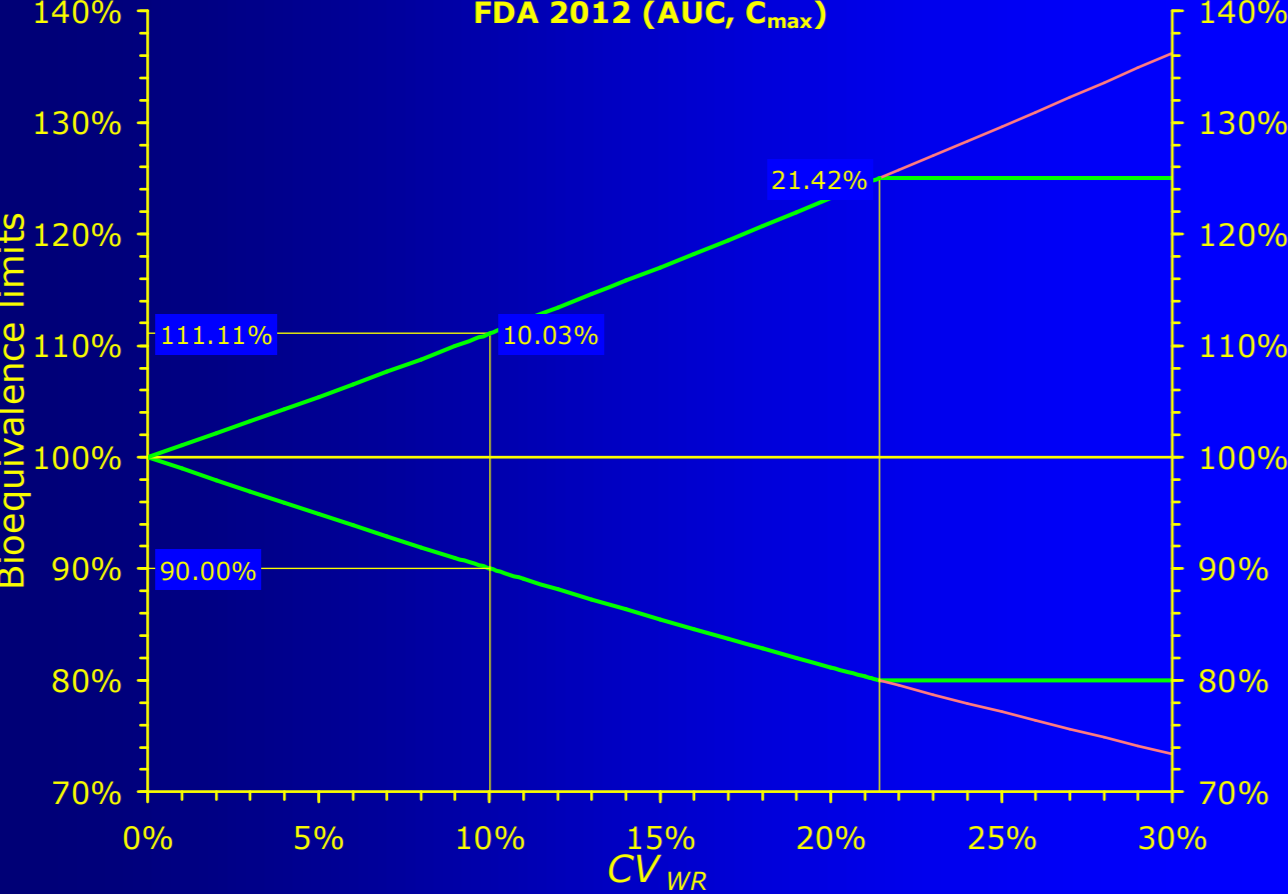
从上图我们可以看到,当参比制剂个体内变异超过21.4%时,方法后范围甚至超出了80.00%-125.00%,为了解决个问题,可以有以下解决方法:
卡参比制剂个体内变异21.4%,超过时即转向传统abe评价。
同时通过rsabe和abe
美国fda则是采用的第二种方法,同时计算abe的结果,并评估受试制剂与参比制剂的个体内标准差比值的变异。对于ntids,推荐使用完全重复(两制剂、四周期、两序列)的设计,统计结果必须通过以下三个评价指标:
rsabe:![]() 的单侧95%置信区间上限应小于等于零
的单侧95%置信区间上限应小于等于零
abe:90%置信区间在80.00%-125.00%之间
受试制剂与参比制剂的个体内标准差比值(σwt/σwr):比值的双侧90%置信区间上限应小于等于2.5
我们都知道,中具有abe评价的模块,该模块采用标准化设计,统计模型已经内置,只需要输入数据即可完成计算。但是窄治疗指数药物(nitids)评价除了abe结果外,还需要比较rsabe和受试制剂与参比制剂的个体内标准差比值双侧90%置信区间的结果,厂家为我们提供了ntids的模板可以完成其余计算,下面我们给大家介绍一下如何使用该模板。
模板流程包含哪些部分
1. 数据输入和数据准备工作流
这一部分是用户使用模板时数据输入的地方,数据输入后对数据相关标识进行定义。

2. rsabe
此部分计算swr和![]() 的单侧95%置信区间上限,评价标准是上限必须小于等于0。
的单侧95%置信区间上限,评价标准是上限必须小于等于0。
3. abe
使用内置bioequivalence工具评价abe,通过标准是:受试制剂和参比制剂几何最小二乘均值比值的90%置信区间在80.00%-125.00%之间。

4. 受试制剂与参比制剂的个体内标准差比值(σwt/σwr)
计算σwt/σwr双侧90%置信区间上限,标准是:上限小于等于2.5。

模板的使用
1. 导入模板
打开phoenix winnonlin,选择file→load project,该模板一次只能评价一个指标。

![]()
2. 导入数据
数据格式可以参考以下截图,常规的变量有subject(个体编号)、period(周期编号)、sequence(序列编号)、formualtion(制剂编号),data为评价的指标,比如auc和cmax,可以直接导入原始auc或者cmax值,也可以导入对数转换后的值。

3. 输入参比制剂和受试制剂标识
输入用户数据中参比制剂和受试制剂的标识符号,比如常用的r和t。

4. 输入评价指标数据是否经过对数转换
评价指标数据如果已经手动ln转换,则在此处输入”y”,如果未经过转换,则输入”n”。
![]()
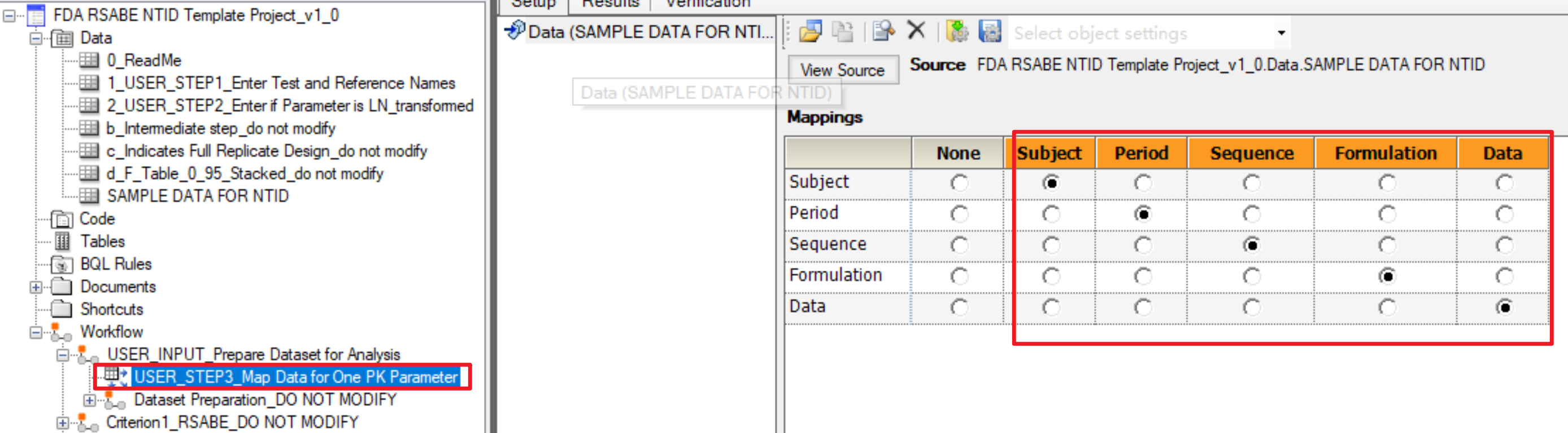
5. 在数据连接中mapping用户数据到指定列
user step 3,在data link中将用户数据表中对应的分类变量和数据手动mapping到对应列,data对应的就是评价指标数据。
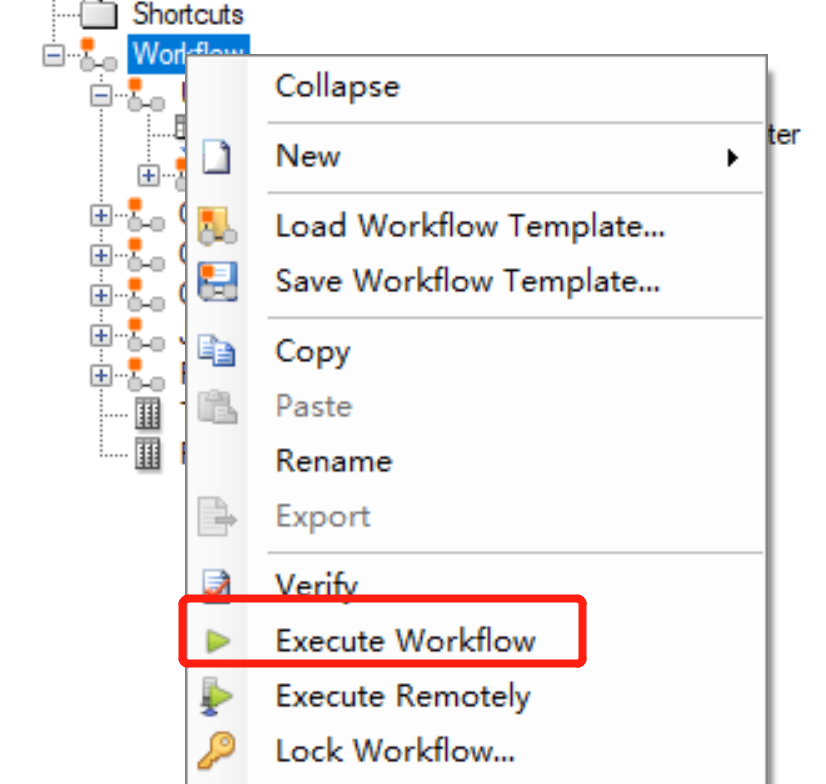
6. 运行模板
选中workflow,鼠标右键,点击execute workflow,等待运行完毕即可(可能需要等待一些时间,切莫强制关闭软件)。
查看结果
1. 结果请点击workflow下的”fina table for ntid be”进行查看
2. 结果可以看下面表格内容
![]()
模板下载地址,如下:
![]() 附件fda_rsabe_for_ntid_template_project_v1_0.zip
附件fda_rsabe_for_ntid_template_project_v1_0.zip
以上就是该模板的全部内容,有任何问题可以联系创腾科技工程师,
联系人:符老师
电话:17812518254
邮箱:
参考资料
1. draft guidance on warfarin sodium, us fda, recommended dec 2012.
2. draft guideline on the investigation of bioequivalence, ema chmp, 24 july 2008, section 4.1.9
3. guidance document - comparative bioavailability standards: formulations used for systemic effects, health canada, may 2012, section 2.1.1.6
4. food and drug administration. draft guidance on carbamazepine. sept 2015.
创腾科技为midd所做的准备
目前,创腾科技为大家提供了产品、临床试验模拟器等产品。

:pk/pd数据建模以及非房室模型分析标杆软件;
ü 可以进行个体建模和模拟,也可以通过非房室模型分析模拟的丰富数据。
:群体pk/pd数据建模和模拟的图形化操作软件;
ü 相对于竞品,具有图形化和人性化操作模式、同步输出常用诊断图形、集成协变量筛选以及模型验证组件等优势,可帮助您在phoenix统一平台完成大部分数据处理和结果报告的工作。
ivivc toolkit:体内体外相关性分析工具;
ü 可通过建模的方式建立体外溶出和体内pk数据之间相关性引,可达到加速制剂研发、豁免临床试验等目的。
:试验模拟器
ü 强大、灵活和直观的临床试验模拟工具,通过设定药物模型,模拟不同的试验方案,结合图形化和统计分析,从而优化下一阶段的方案设计。
>> 以往案例,点击标题查看
「intercept制药公司」一家新兴的全球生物制药公司,需要开发一种奥贝胆酸(oca)的给药策略,用于治疗原发性胆道胆管炎(pbc)患者。certara科学家使用phoenix nlme建立了一个生理pk模型来定义有或无肝损害的pbc患者oca全身和肝脏暴露之间的关系。建模结果证实了oca给药方案对pbc患者的安全性和有效性。
案例二: nlme & trial simulator: m&s优化药物iii期试验设计来帮助获得fda批准(1)
建模和模拟(m&s)正在改变药物开发以及药物如何接受监管审查的方式。certara公司旗下的phoenix nlme和trial simulator等定量药理学相关软件利用动物试验和临床试验现有数据建模,通过模拟减少不确定性,提高药物研发效率和生产力,并为赞助公司的药物研发做出更具成本效益的决策。
案例三: phoenix nlme & trial simulator设计iii期试验来帮助获得fda批准 (2)
m&s在药物开发和监管申报中扮演着越来越重要的角色。在本案例中,phoenix nlme和trial simulator扮演了重要角色,通过模拟评估了iii期试验复杂的适应性设计,并在其中选择一种符合fda要求并最有可能成功的设计。经过优化的研究设计使文中的口服睾酮产品获得批准,目前已将该药物投放市场。
>> 以往文章,点击标题查看
phoenix nlme专为当代科学家设计的现代化pk/pd建模软件
phoenix nlme专为pk/pd研究者设计的现代化pop pkpd建模软件
欢迎 「 点击 」

扫 码 立 即 注 册
联系电话:010-82676188